GROEPLEIER: Prof Erick Strauss
Posisie: Professor
Kantoor: A123 JC Smuts Building
Foon: +27-(0)21-808-5866
Faks: +27-(0)21-808-5863
E-pos: estrauss@sun.ac.za
Opvoedkundige agtergrond
PhD, Cornell Universiteit (VSA), 2003
Toekennings
Raikes medalje, Suid-Afrikaanse Chemiese Instituut (2013)
Beckman-Coulter Silwer medalje, Suid-Afrikaanse Vereniging vir Biochemie en Molekulêre Biologie (2010)
NRF Presidentstoekenning (P-gradering) (2008-2012)
Rektorstoekenning vir Voortreflike Onderrig, Universiteit Stellenbosch (2007)
Navorsingsfokus
Chemiese Biologie, Meganistiese Ensimologie, Ontwikkeling & Ontdekking van Antimikrobiese MIddels, Biokatalise
Navorsingsopsomming
Die Strauss Lab se kernnavorsingspogings is in die multidissiplinêre veld van Chemiese Biologie. Ons fokus hoofsaaklik op die chemie en biologie van die alomteenwoordige metaboliese kofaktor koënsiem A, en op lae molekulêre gewig tiol-afhanklike redoksbiologie. Ons pas ook die kundigheid wat ons op hierdie wyse verkry toe op die ontwerp en ontwikkeling van nuwe antimikrobiese middels - veral middels wat siektes teiken wat in die Afrika- gesondheidskonteks belangrik is, soos malaria en tuberkulose.
Navorsingsbeskrywing
Belangstellings
Navorsing in die Strauss-groep is in die algemeen gefokus op die verhoging van ons begrip van die ensimologie van koënsiem A (KoA) en ander medisinaal-relevante lae molekulêre gewig tiole, en die toepassing van hierdie kennis in biokatalise en die ontwikkeling van antimikrobiese middels. Ons doel is om nuwe teikens in belangrike menslike patogene soos Staphylococcus aureus, Mycobacterium tuberculosis en Plasmodium falciparum te identifiseer wat hul afhanklikheid van hierdie noodsaaklike kofaktore uitbuit.
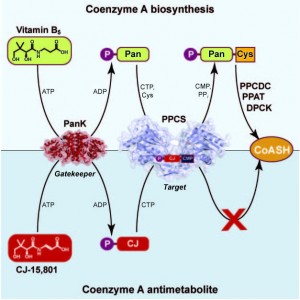
Ons navorsingstrategie fokus op die opklaring en bestudering van alle aspekte van die ensieme wat betrokke is in die biosintetiese weg van die tiol-bevattende kofaktor, en die toepassing van hierdie kennis in die ontwerp van inhibeerders van hierdie ensieme asook daardies wat gebruik maak van die kofaktor. Dikwels is sulke inhibeerders is ook analoë van die natuurlike kofaktor, en kan dus biokatalities berei kan word deur koöptering van die natuurlike biosintetiese ensieme. In sommige gevalle gebeur dit natuurlik soos gewys in die figuur hieronder vir die natuurproduk CJ-15.801, wat hierdie proses gebruik as deel van sy inhibisiestrategie.

Gereedskap
Ons gebruik 'n wye verskeidenheid van gereedskap en tegnieke in ons laboratoriums, en jy kan verwag om mense te ontmoet wat molekulêre biologie doen, of proteïenuitdrukking en -suiwering, essaï-ontwikkeling, asook organiese sintese. Ons laboratoriums is goed toegerus om hierdie studies uit te voer, en ons steun swaar op die universiteit se uitstekende MS fasiliteit wat LC/MS en MALDI analise dienste aanbied. Ons werk ook nou saam met die sinteties organiese groep van prof Willem van Otterlo in die Departement Chemie en Polimeerwetenskap
Samewerking
Ons werk nou saam met verskeie internasionale navorsingsgroepe in die VSA, Spanje, Italië en Australië. Samewerkings wat alreeds vrugte gewerp het is dié die laboratorium van Hong Zhang aan die University of Texas Southwestern Medical Center in die VSA op die strukturele biologie van pantotenaat kinases, met die groep van Joaquín Ariño van die Universitat Autonoma de Barcelona in Barcelona, Spanje op KoA biosintese in gis, en met Kevin Saliba se groep by die Australian National University in Canberra, Australië op die ontwikkeling van antiplasmodiale middels wat KoA biosintese en benutting teiken.
Geselekteerde
publikasies
Volledige lys beskikbaar by ReseachGate
The Antibiotic CJ-15,801 is an Antimetabolite which Hijacks and then Inhibits CoA Biosynthesis. R. van der Westhuyzen, J.C. Hammons, J.L. Meier, S. Dahesh, W.J.A. Moolman, S.C. Pelly, V. Nizet, M.D. Burkart and E. Strauss. Chem. Biol. 19, 559–571 (2012).
Functional Mapping of the Disparate Activities of the Yeast Moonlighting Protein Hal3. J.A. Abrie, A. González, E. Strauss and J. Ariño. Biochem. J. 442, 357-368 (2012).
Grand challenge commentary: Exploiting single-cell variation for new antibiotics. E. Strauss. Nat. Chem. Biol. 6, 873–875, (2010).
Biocatalytic Production of Coenzyme A Analogues. E. Strauss, M. de Villiers and I. Rootman. ChemCatChem 2, 929-937, (2010).
Michael acceptor-containing coenzyme A analogues as inhibitors of the atypical coenzyme A disulfide reductase from Staphylococcus aureus. R. van der Westhuyzen and E. Strauss. J. Am. Chem. Soc. 132, 12853-12855 (2010).
3-Fluoroaspartate and Pyruvoyl-Dependent Aspartate Decarboxylase: Exploiting the Unique Characteristics of Fluorine to Probe Reactivity and Binding. J. de Villiers, L. Koekemoer and E. Strauss. Chem. Eur. J. 16, 10030-10041, (2010).
Moonlighting proteins Hal3 and Vhs3 form a heteromeric PPCDC with Ykl088w in yeast CoA biosynthesis. A. Ruiz, A. González, I. Muñoz, R. Serrano, J.A. Abrie, E. Strauss, and J. Ariño. Nature Chem. Biol. 5, 920-928, (2009).

